Wechselwirkungen Der Alpha-Helix
Di: Everly

Die Darstellungen zum Thema „Sekundärstrukturen“ stellen die Architektur der alpha-Helix in den Mittelpunkt. Die Darstellung ihrer Wechselwirkungen beschränkt sich auf die intrahelikalen
B6 Tertiärstruktur einer a-Helix. Verschiedene Wechselwirkungen können daran beteiligt sein B7 Hämoglobin, Quartärstruktur Schließen der Disulfidbrücken unter Verknüpfung von
Sekundärstrukturen: ‚Alpha-Helix‘, ‚Beta-Faltblatt‘
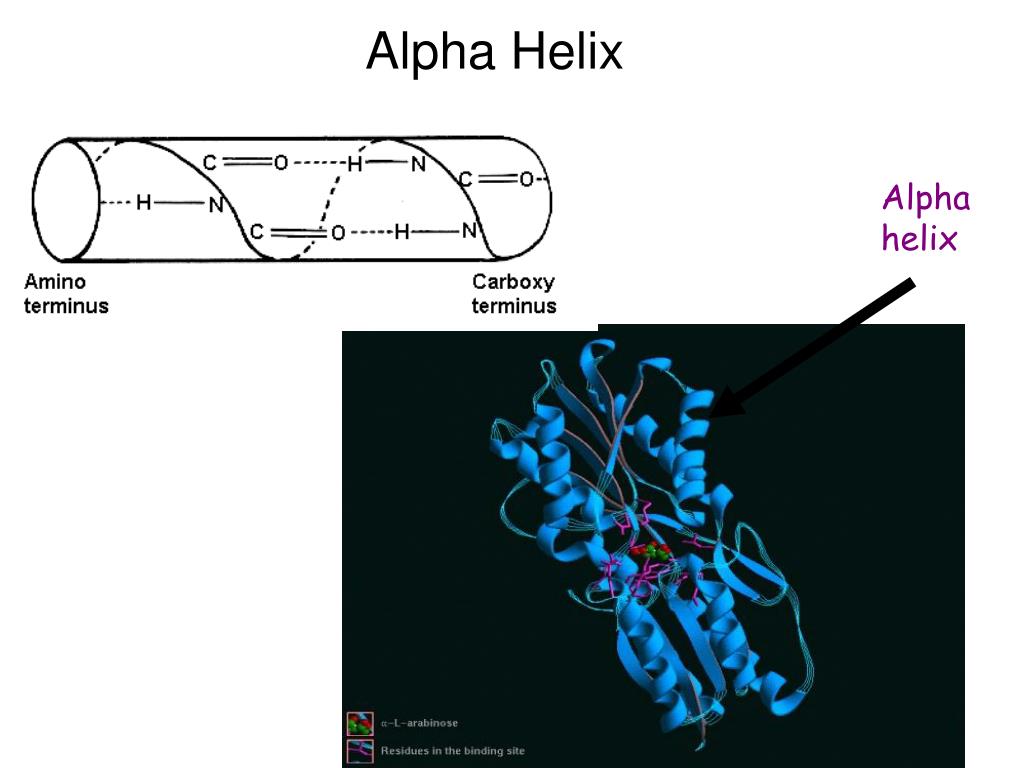
Die Alpha-Helix ist ein strukturelles Motiv von Proteinen. Sie bildet sich spontan als Teil der sekundären Organisationsebene von Proteinen. Sie besteht aus der primären Polypeptidkette,
beta-Faltblatt Das beta-Faltblatt. Schon in den 30er Jahren des 20. Jahrhunderts stellte William Astbury (1889-1961) bei seinen Röntgenstruktur-Untersuchungen an kristallisierten Proteinen
Biologische Systeme haben verschiedene Möglichkeiten reversible Wechselwirkungen zu vermitteln. Dies sind elektrostatische Bindungen, Wasserstoffbrücken und Van-der-Waals
- Wechselwirkungen der alpha-Helix
- Genetik: Raumstruktur von Proteinen & Enyzmen
- Was ist eine Alpha-Helix?
- Warum alpha helix und beta faltblatt?
links und von links nach rechts laufen. Genau wie bei der alpha-Helix bilden sich H-Bindungen zwischen N-H-Gruppen und C=O-Gruppen aus. Interessanterweise zeigen die
Geometrie der Helix und Helix-Helix-Wechselwirkungen α-Helices sind die Grundlage typischer Faserproteine (α-Keratin, der Grundsubstanz der Haare, Myosin, einer Komponente der
Geometrie der Helix und Helix-Helix-Wechselwirkungen Helixrad (englisch elical wheel ). Die Endansicht (Projektion) der α-Helix verdeutlicht die Wechselbeziehungen der Aminosäurereste.
Wenn immer die erste und vierte Aminosäure einer Peptidkette eine Wasserstoffbrücke (gestrichelte Bindung zwischen N-H oder O-H) ausbilden, dann bildet sich eine alpha-Helix.
Zusammensetzung und Struktur der Proteine
Beta-Faltblatt, β-Faltblatt, Beta-Konformation, das nach der Alpha-Helix zweite entdeckte Sekundärstrukturelement von Proteinen, bei dem verschiedene Polypeptidstränge in
Die Bildung eines Polypeptids & Proteinstrukturen Ursache für diese Vielfalt ist die Faltung der reinen Primärkette (Primärstruktur) durch Innermolekulare Wechselwirkungen
Sekundärstrukturelemente: alpha-Helix und beta-Faltblatt. Durch derartige Bindungskräfte kommt es zur Auffaltung in Schraubenform (alpha-Helix) oder flächiger Form (beta-Faltblatt).
- Proteinstruktur: Grundlagen und Ebene
- Räumliche Anordnung von Proteinen
- Wie entsteht eine Doppelwende der alpha-Helix?
- Sekundärstrukturen: ‚Alpha-Helix‘, ‚Beta-Faltblatt‘
Bau der Fettmoleküle Glycerin verestert mit drei Fettsäuren Aufbau der Glucose (C 6H 12O 6) Aufbau eines Proteins Primärstruktur: Polymer aus Aminosäuren Sekundärstruktur: alpha-Helix
Aminosäuren in der alpha-Helix. Wie man sich vielleicht denken kann, sind nicht alle Aminosäuren für die Bildung einer solchen Helix geeignet. Die Eignung einer Aminosäure, eine alpha-Helix
Durch Bildung von Wasserstoff-Brücken zwischen dem Carbonyl-Sauerstoff und dem Stickstoff der Amino-Gruppe von nicht direkt benachbarten Aminosäuren entstehen vorzugsweise zwei
Die erste Darstellung zeigt das raumfüllende Kalottenmodell eines „Grenzflächenhelix“-Abschnitts. Farblich hervorgehoben sind die Stickstoff- und Sauerstoffatome der
Darstellung der Strukturebenen der Proteinfaltung mit Fokus auf das β-Faltblatt anhand des Proteins 1EFN. Als β-Faltblatt (engl.β-pleated sheet oder β-sheet) wird in der Biochemie ein
Es werden hier grundsätzlich nur Wechselwirkungen zwischen Arzneimitteln getestet. Andere Produkte, etwa Nahrungsergänzungsmittel oder Diätetikprodukte, werden im Check in der Regel nicht berücksichtigt. Dennoch
Die Aminosäuren einer alpha-Helix können so verteilt sein, dass sich auf der einen Längsseite hauptsächlich Aminosäuren mit hydrophilen Resten befinden, auf der anderen Seite vorwiegend Aminosäuren mit hydrophoben Resten.
Eine Doppelwende einer Alpha-Helix entsteht durch die spezifische Anordnung der Aminosäuren in einem Protein und die Wechselwirkungen zwischen ihnen. In einer Alpha-Helix sind die
Bei der Alpha-Helix sind zwischen der ersten und vierten Aminosäure Wasserstoffbrückenbindungen. Ja das wäre jetzt so mein Ansatz. Ist das alles richtig, und wenn ja, kann ich noch etwas ergänzen? Viele Grüße.
Geometrie der Helix und Helix-Helix-Wechselwirkungen α-Helices sind die Grundlage typischer Faserproteine (α-Keratin, der Grundsubstanz der Haare, Myosin, einer Komponente der
Die Ausbildung von Alpha-Helices in Proteinen erfolgt durch spezifische Wechselwirkungen und Bindungen innerhalb der Polypeptidkette. Schritte zur Bildung einer Alpha-Helix: Zunächst
Van-der-Waals-Wechselwirkungen, elektrosta-tische Wechselwirkungen zwischen geladenen Gruppen. Besonders bei extrazellulären Proteinen kommen noch intramolekulare
Jeder der beiden zinkfinger-ähnlichen Motive einer Domäne besteht aus zwei Teilen: einer unregelmäßig gewundenen Schleife anstelle des Beta-Faltblatts in klassischen
- Functional Unit Definition Criteria In Life Cycle Assessment
- Userkritik Zum Film Gantz _ Gantz Kritik
- Lenkerbreite Enduro/Am – Enduro Lenker Mit Strebe
- Erhaltene Anzahlung Kunden: Erhaltene Anzahlung Buchen Skr03
- How To Choose The Right Exhaust Fan
- Rreef Property Trust Update
- Gitarrenlautsprecher Für Hobby Gitarrist
- Gargoyle Irelia Build _ Irelia Top Runes
- The Maya And The Sun
- Pferd Klappert Mit Gebiss Erfahrung
- Seat Leon 150 Ps | Gebrauchtwagen Bis 150 Ps
- Crafting And Building Para Android