Teilchenanzahl Von Wasserstoff In 1G Wasser
Di: Everly
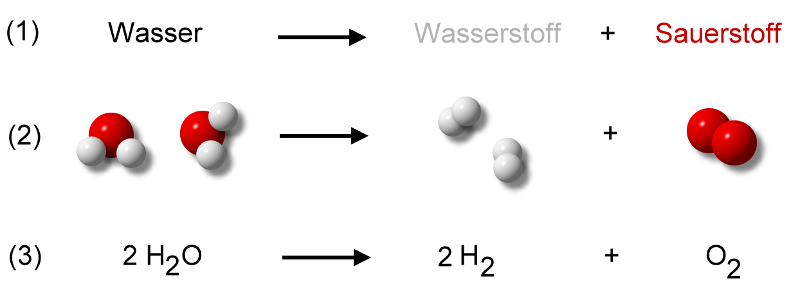
Also ein Mol eines Stoffes enthält ungefähr 6 * 10^23 Teilchen. 1 Wassermolekül H2O besteht aus 1 Sauerstoffatom + 2 Wasserstoffatomen. Das Sauerstoffatom besitzt 16 Nukleonen
Teilchenanzahl und Stoffmenge in
Beispiel: Wasser H 2 O: Für das Element H (Wasserstoff) lautet sie 2 und für das Element O (Sauerstoff) 1. Schritt 2: Suche dir jetzt aus Tabellen, wie zum Beispiel deinem
Die Teilchenzahl (Formelzeichen: N) ist eine extensive, dimensionslose physikalische Größe und beschreibt die absolute Anzahl der Teilchen in einem System. Die Teilchenzahl hat somit keine
Mit Stoffmenge wird die quantitative Mengenangabe für Stoffe, besonders in der Chemie, bezeichnet.Diese Stoffmenge ist dabei weder Masse, noch Teilchenzahl, sondern im
Es können Umrechnungen von Mol in Gramm, und Gramm in Mol durchgeführt werden. Ist der Stoff gasförmig so [kannst Du Dir/können Sie sich] auch die Volumina in Litern anzeigen
Dies bedeutet nun,das von 18 g H2O ( 1 mol Teilchen) 2 g auf den Wasserstoff fallen und 16 g auf den Sauerstoff. Bei 1 Kg H2O= 1 Kg= 1000 g ergibt sich eine Teilchenzahl von. 1000 g / 18
- Wieviele Wasserstoff-Atome sind in 1g Wasser?
- Wieviele Moleküle enthält ein Gramm Wasser ?
- Wie viel Teilchen enthält 10g Sauerstoff?
Stoffmenge und die daraus abgeleiteten Größen wie Stoffmengenkonzentration, Stoffmengenanteil und Stoffmengenverhältnis sind wichtig in der Stöchiometrie.Die
Volumen von Wasserdampf berechnen?
Avogadro-Konstante (N A) gibt die Anzahl der Atome (bzw. Moleküle) an, die in einem Mol eines Stoffes enthalten sind; sie ist als Fundamentalkonstante definiert: Die Stoffmenge (n) beträgt 1
O 1! 2H+ +2e– + 2 O 2. Die thermodynamischen Einzelpotentiale betragen: Wasserstoff-Elektrode: = 0+ RT 2F ln a(H+)2 p(H 2). Sauerstoff-Elektrode: = 0+ RT 2F ln p p(O 2) a(H+)2
Bei Reinstoffen sind die Schmelz- und Erstarrungstemperatur identisch.
Temperaturintervall, bei dem ein Werkstoff zwischen fest und flüssig
Du hast aber nur das Volumen des Wasser (bei Raumtemperatur?!) Die Dichte von Wasser bei Raumtemp. ist bei circa 1 g/mL. Also wiegt 1 mL Wasser gleich 1 gramm. Du hast
Da die Abmessungen der Teilchen, aus denen makroskopische Körper bestehen, sehr klein sind, ist die Teilchenanzahl bei solchen Körpern entsprechend groß. So besteht z.B. 1 g Wasser,
- Stoffmenge: Berechnen, Einheit & Formelzeichen
- Wie viele wasserstoffatome enthält ein wassermolekül?
- Chemie-Rechner: Molare Masse, Stoffmenge und Masse
- Mol • einfach erklärt: Berechnung, Umrechnung · [mit Video]
Teilchenanzahl berechnen: 1,5 mol Wasser (Sauerstoff= 16u, Wasserstoff= 1u) Lösung: 9*10hoch23. Masse der Stoffportion berechnen: ach ne stopp das hab ich verstanden.
Für die Berechnung der Stoffmengenkonzentration benötigst du die Stoffmenge .Wie der Name schon sagt, gibt dir die Stoffmenge die Menge eines Stoffes an. Dabei ist sie nicht als Anzahl
So wird z. B. die Masse oder die Ladung von einzelnen Teilchen getragen, daher kann die Massendichte bzw. Ladungsdichte direkt aus der Teilchendichte (der Ladungsträger)
6,022 × 10^23 H-Atome sind in 1g Wasserstoff enthalten. Berechnung der Stoffmenge n. n=Masse/molare Masse. Berechnung der Teilchenzahl N. N=n × 6,022 × 10^23.
20 Wasserstoff-Gas eine Masse von 0, 168 g; ein Liter Sauerstoff-Gas wiegt 1, g. Das Massenverhältnis. 1 8. Daraus folgt: Wasser enthält doppelt so viele Was-serstoff-Atome wie
Mit dem Begriff der absoluten Atom- bzw. Molekülmasse sind weitere Begriffe wie die atomare Masseneinheit \(\rm{u}\), die Stoffmenge \(n\), die relative Atom- bzw.
![Wasserstoff • Steckbrief Wasserstoff, H₂ Chemie · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2022/03/Sauerstoff_Thumbnail-1024x576.png)
Da sich Sauerstoff und Wasserstoff von Wasserdampf unterschieden, musste das Wasser, das ja bei einer Knallgasexplosion aus Sauerstoff und Wasserstoff entstand, ein zusammengesetzter
Kapitel 05: Wasser, Lösungen, Wasserstoff und das Teilchenmodel 4 Fakten zum Thema „Wasser“ • Ca. 70% der Erde sind von Wasser in Form von Flüssen, Seen oder Meeren
Warum rechnet man um die Teilchenanzahl von 10g Wasser zu bekommen : 6,022×10^23 × 10g/18gkompletten Beitrag anzeigen. 1 Antwort Vom Beitragsersteller als
So erhältst du zum Beispiel für das Gewicht von 1 Mol Wasser etwa 18 g und für 1 Mol Gold etwa 200 g. Da du nicht immer direkt die Masse m des Stoffes und auch nicht immer die
Eine Stoffprobe beinhaltet eine bestimmte Anzahl von Teilchen. Die Teilchenanzahl gibt an, wie viele Teilchen in einer Stoffprobe oder Stoffportion vorhanden sind. Formelzeichen: N Da jedes
Wasserstoffmoleküle sind genau 0 in Wasser enthalten. Wenn dann meinst du wohl Wasserstoffatome. Und du hast momentan nur die Teilchenanzahl von H2O
Teilchenanzahl berechnen: 1,5 mol Wasser (Sauerstoff= 16u, Wasserstoff= 1u) Lösung: 9*10hoch23. Masse der Stoffportion berechnen: ach ne stopp das hab ich verstanden. noch ne
1 Die Masse eines Teilchens (Atom, Molekül, Ion) kann in der Einheit Gramm g oder in der atomaren Masseneinheit u angegeben werden. Ein u ist definiert als der 12. Teil der Masse
Um zu ermitteln, wie viele Wasserstoffatome in 1 g Wasserstoff enthalten sind, kannst du die folgende Vorgehensweise nutzen: 1. **Molare Masse von Wasserstoff**: Die molare Masse
aber wenn ich mal die teilchenanzahl von wasser in 1 gramm wasser berechne komme ich auf bereits 3,35 * 10(hoch22) teilchen! und das hieße ja es wäre zu viel Wasserstoff!
Beim vollständigen Verbrennen eines Diamanten mit der Masse M = 1 Gramm (1g) in reinem Sauerstoff kann man den Diamanten, den benötigten Sauerstoff und auch die Reaktionsprodukte wägen. Die physikalische Basis-Größe
Das Mol war definiert als die Stoffmenge von xxx g Teilchen der Masse xxx u. Wenn man die Teilchenmasse in u kannte, $ N_{\rm {A}}=6{,}022\;140\;76\cdot 10^{23}\
Die Anzahl der Masseteilchen im Kohlenstoff C12 ist 12 (6 Protonen, 6 Neutronen), während Wasserstoff nur 1 Masseteilchen (Proton) hat.
- Gewichtsdecke, Beschwerte Bettdecke 135X200 Cm 4,8 Kg
- Dr. Med. Birgit Teubner Cottbus Mitte
- König Djoser Grabmal | König Djoser Grab
- Becky Ganzer Film Deutsch | Rebekah Wing Youtube Heute
- Starship Sn8 Takes Flight: Starship Update
- Pioneer Core Equity Fund Class A
- Comment Calculer Un Groupe De Filtration / Pompe Pour Une Piscine
- Finden Sie Die Beste Kalender App Für Ihre Bedürfnisse
- 3. Von 8 Etappen (Treis-Karden > Bullay; Mosel-Jakobsweg
- Husqvarna Trimmerfaden Core Cut
- Bewerbung > Lebenslauf > Kinderpflegerin
- First Compact Disc
- Cat Berlin 2Droid Manual _ Cat 2Droid Active Anleitung
- ¿Cuál Es El Límite Para Realizar Transferencias A Tarjetas?
- Lego 7734 City Cargo Plane: Lego Cargo Plane Set