Quotient De Réaction Et Constante D’équilibre
Di: Everly
2. Ecrire l’équation de la réaction qui se produit lors de la mise en solution dans l’eau. 3. Calculer successivement les concentrations molaires, dans la solution, de l’ion oxonium, de l’ion lactate
• Le quotient de réaction peut être calculé pour une réaction à tout moment, pas seulement pour les réactions dans les constantes d’équilibre d’équilibre. • Si la constante d’équilibre est égale
Exprimer et calculer une constante d’équilibre Méthode
critère d’évolution spontanée: Au cours du temps, la valeur du quotient de réaction Q r tend vers la constante d’équilibre K. – Q r initial est égal à la constante d’équilibre K : le système
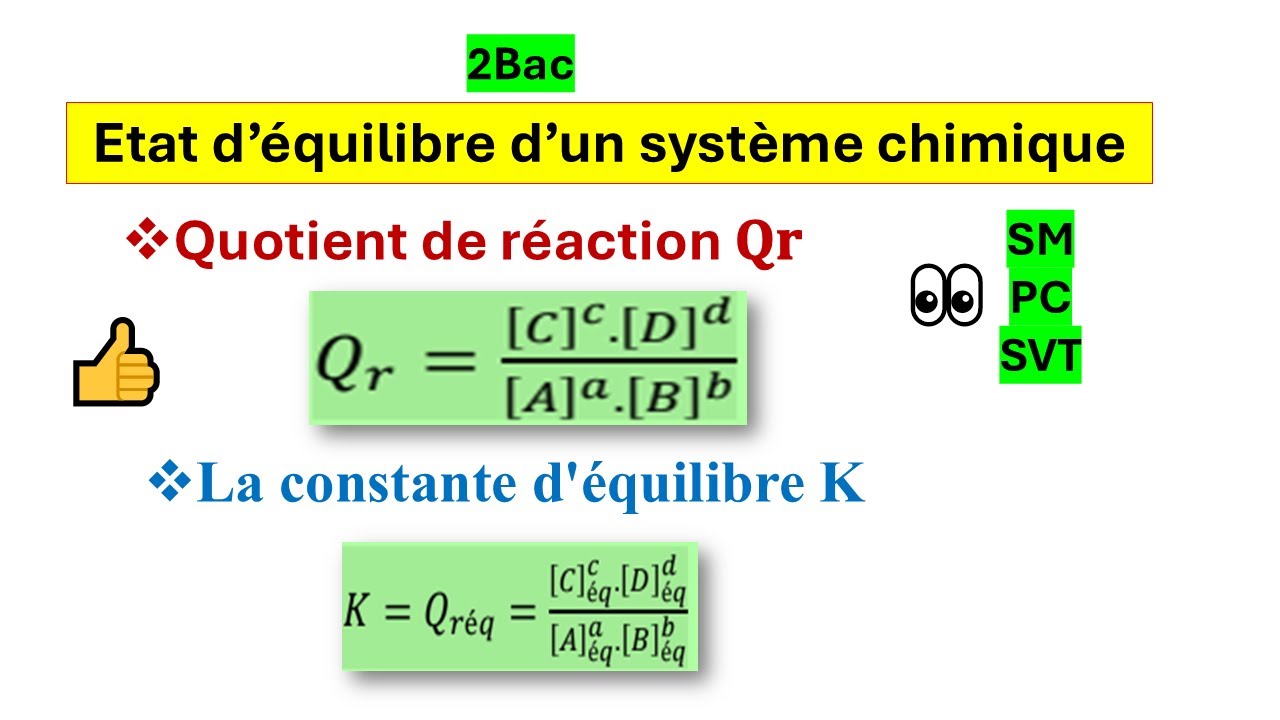
Le quotient de réaction est une grandeur qui caractérise un système chimique dans un état donné. Sa valeur , au cours de la réaction , nous renseigne sur l’évolution du système
- Différence entre la constante d’équilibre et le quotient de réaction
- Exercices constante d équilibre et quotient de réaction
- Etat d’équilibre D’Un Système Chimique : Cours & Exercices
DOSSIER QUILIBE CHIMIQUE ET QUOTIENT DE ACTION On dit qu’un équilibre chimique : αA(aq) + βB(aq) γC(aq) + δD(aq), caractérisé par une constante d’équilibre K, évolue : – dans
Le quotient de réaction et la constante d’équilibre sont deux termes utilisés pour expliquer les réactions chimiques qui se produisent dans un système. Le quotient de réaction donne une
Dans l’état d’équilibre d’un système, le quotient de réaction, $Q_{r,eq}$, prend une valeur indépendante de la composition initiale du système. À chaque équation de réaction est
Quotient de réaction ; constante d’équilibre
On compare ce quotient de réaction à la constante d’équilibre : Q_r \gt K. Ainsi, le système n’est pas en équilibre et va évoluer selon le sens indirect de l’équation de réaction. Cette évolution
Quotient de réaction – constante d’équilibre Chapitre 4 allal Mahdade Groupe scolaire La Sagesse Lycée qualifiante 19 novembre 2016 1 (2016-2017) 2ème Bac SM allal Mahdade. Quotient de
Le quotient de réaction est une grandeur qui caractérise un système chimique dans un état donné. Sa valeur, au cours de la réaction, nous renseigne sur l’évolution du système considéré.
QCM N° 04 sur le quotient de réaction et l’équilibre chimique, questionnaire sous forme d’un tableau. QCM N° 04. Quotient de réaction : équilibre chimique. Cours : QCM N° 04 Chimie :
Quotient de réaction ; constante d’équilibre Introduction I) QUOTIENT DE REACTION DANS UN ETAT QUELCONQUE 1) Définition 2) Calcul du quotient de réaction Qr : règles à appliquer a)
- Bilder von Quotient de réaction et constante d’équilibre
- L’évolution spontanée d’un système chimique Cours
- Videos von Quotient de réaction et constante d’équilibre
- équilibre chimique quotient de réaction Qr et constante d’équilibre K
Equilibre Chimique en Terminale : cours et exercices corrigés
Le quotient de réaction à l’équilibre, noté Q r,éq, est la valeur que prend le quotient de réaction au moment où l’état d’équilibre du système chimique est atteint : (les
Exercices constante d’équilibre et quotient de réaction a. Une solution contient un mélange équimolaire d’acide éthanoïque et d’ion éthanoate. Dans la solution, [??3? ?]=[??3? −]=0,1 ? .
Retrouvez la leçon et de nombreuses autres ressources sur la page Constante d’équilibre. Nos manuels. Nos classiques . Se connecter. S’inscrire. Physique-Chimie Terminale Spécialité.
Apprenez la définition, la formule et les propriétés de la constante d’équilibre (K) pour les réactions chimiques homogènes. Découvrez comment calculer et utiliser K pour prédire le

Quotient de réaction et constante de réaction dans l’état d’équilibre : D Pour calculer le quotient de réaction dans l’état d’équilibre, on utilise l‘expression suivante : Qr,éq = aq éq aq éq aq éq
quotient de réaction, constante d’équilibre.
Ce site propose des fiches de cours de chimie pour le bac S. Il explique les notions de quotient de réaction, constante d’équilibre et critère d’évolution spontanée, avec des exemples et des
Le quotient de réaction à l’état d’équilibre (noté Q r, é q) est la valeur que prend le quotient de réaction lorsque l’état d’équilibre du système chimique est atteint. A l’état d’équilibre, les
Lorsqu’un système chimique atteint son état d’équilibre (les concentrations en réactifs et produits n’évoluant plus) sa constante de réaction est : Qr(équilibre) = Qr eq = K. K est appelé la
Exemples de constantes d’équilibre 1. Équilibre en phase aqueuse 2. Équilibre entre deux phases 2. Équilibre hétérogène III. Dépendance de la température 1. I. Activité et constante d’équilibre
Le quotient de réaction est le rapport entre les produits et les réactifs dans une réaction, à un moment donné. Il est également noté Q. Il est calculé de la même manière que la constante
– Le quotient de réaction dépend de l’avancement x de la réaction. – La question que l’on peut se poser : Que vaut le quotient de réaction lorsque l’état d’équilibre est atteint ? – Sa détermination peut s’effectuer à partir d’une étude
On considère un solide ionique AxB y, qui en solution, donne les ions Am+ et Bn–. Si le solide coexiste avec ses ions, on parle d’équilibre de dissolution. Il s’écrit : AxB (s) xAm+(aq) +
On se trouve à l’état d’équilibre du système chimique. Avec a, b, c, d nombres stœchiométriques et A, B, C et D réactifs et produits. Le quotient de réaction Qr de cette réaction (à un instant
La constante d’équilibre d’une réaction non totale se note « K » et correspond à la valeur prise par le quotient de réaction lorsque l’équilibre est atteint. Si la constante d’équilibre
Le quotient de réaction dans l’état d’équilibre d’un système, à une température donnée, a une valeur indépendante de la composition initiale de ce système. 2) Définition : La constante
On constate que le quotient de réaction est pratiquement constant aux erreurs expérimentales près. Remarques prof : La valeur moyenne obtenue est Qr,éq ≈ 1,5.10-5. L’enseignant identifie
En solution aqueuse, la constante d’équilibre K d’une transformation chimique peut être exprimée avec les concentrations à l’équilibre des réactifs et des produits. Elle doit être connue pour
Le quotient de réaction fournit des indications sur la direction dans laquelle la réaction évoluera pour atteindre l’équilibre, en comparant avec la constante d’équilibre (K). Utilité C’est un outil
Il est possible de prévoir l’évolution d’un système chimique en comparant son quotient de réaction Q_r à la constante d’équilibre K. On étudie la réaction entre les ions oxonium d’une solution
Expliquer la notion d’équilibre chimique et comment elle est liée aux vitesses de réaction. Écrire l’expression de la constante d’équilibre associée à une équation chimique. Prédire le sens
- Battle Of Stirling Bridge Btl28
- The Big Bang Theory: So Sieht Howard-Darsteller Simon Helberg Heute Aus
- How To List All Files/Images In A Website
- New York City Nach Washington Dc Zug
- Contrat De Location De Coffre-Fort
- Sprachzertifikat Dalf – Delf Dalf Zertifizierung
- Nodules Rhumatoïdes : Symptômes, Causes Et Images
- Chocolate Tea In London – Afternoon Tea In London
- Rom Street View _ Google Street View Italy
- Köln: Nachtwächter-Rundgang Durch Die Altstadt Auf Deutsch
- Filing For Custody, Paternity